I. HUKUM DASAR ILMU KIMIA
a. Hukum Kekekalan Massa (Hukum Lavoisier)
“Massa zat sebelum dan sesudah reaksi adalah sama”.
Contoh:
S + O 2 → SO 2
2 gr 32 gr 64 gr
“Massa zat sebelum dan sesudah reaksi adalah sama”.
Contoh:
S + O 2 → SO 2
2 gr 32 gr 64 gr
b. Hukum Perbandingan Tetap (Hukum Proust)
“Perbandingan massa unsur dalam tiap senyawa adalah tetap”
Contoh:
H 2 O → massa H : massa O = 2 : 16 = 1 : 8
“Perbandingan massa unsur dalam tiap senyawa adalah tetap”
Contoh:
H 2 O → massa H : massa O = 2 : 16 = 1 : 8
c. Hukum Perbandingan Berganda (Hukum Dalton)
“Jika dua unsur dapat membentuk dua senyawa atau lebih, dan massa salah satu unsur sama, perbandingan massa unsur kedua berbanding sebagai bilangan bulat dan sederhana”.
Contoh:
– Unsur N dan O dapat membentuk senyawa NO dan NO 2
– Dalam senyawa NO, massa N = massa O = 14 : 16
– Dalam senyawa NO 2 , massa N = massa O = 14 : 32
– Perbandingan massa N pada NO dan NO 2 sama maka
perbandingan massa O = 16 : 32 = 1 : 2
“Jika dua unsur dapat membentuk dua senyawa atau lebih, dan massa salah satu unsur sama, perbandingan massa unsur kedua berbanding sebagai bilangan bulat dan sederhana”.
Contoh:
– Unsur N dan O dapat membentuk senyawa NO dan NO 2
– Dalam senyawa NO, massa N = massa O = 14 : 16
– Dalam senyawa NO 2 , massa N = massa O = 14 : 32
– Perbandingan massa N pada NO dan NO 2 sama maka
perbandingan massa O = 16 : 32 = 1 : 2
d. Hukum Gas Ideal
Untuk gas ideal atau suatu gas yang dianggap ideal berlaku rumus :
PV = n RT
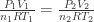
Keterangan:
P = tekanan (atmosfir)
V = volume (liter)
n = mol = gram/Mr
R = tetapan gas (lt.atm/mol.K)
T = suhu (Kelvin)
Dari rumus tersebut dapat diperoleh :
Untuk gas ideal atau suatu gas yang dianggap ideal berlaku rumus :
PV = n RT
Keterangan:
P = tekanan (atmosfir)
V = volume (liter)
n = mol = gram/Mr
R = tetapan gas (lt.atm/mol.K)
T = suhu (Kelvin)
Dari rumus tersebut dapat diperoleh :
II. MASSA ATOM RELATIF DAN MASSA MOLEKUL RELATIF
III. KONSEP MOL
a. Dalam ilmu kimia satuan jumlah yang digunakan adalah mol
b. satu mol adalah sejumlah zat yang mengandung 6,02 x 10^23 partikel
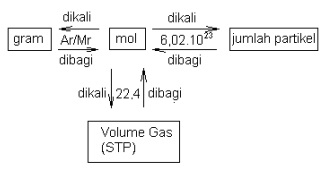
Hubungan Mol dengan jumlah partikel
Jumlah Partikel = mol x 6,02 x 10^23
mol = Jumlah partikel / 6,02 x 10^23
Hubungan Mol dengan Massa
Untuk unsur :
- mol = gram / Ar
- gram = mol x Ar
Untuk senyawa :
- mol = gram/Mr
- gram = mol x Mr
Hubungan Mol dengan Volume Gas
Setiap satu mol gas apa saja keadaan standard (0oC, 1 atm) mempunyai volume : 22, 4 liter.
Setiap satu mol gas apa saja keadaan standard (0oC, 1 atm) mempunyai volume : 22, 4 liter.
- Volume gas = mol x 22,4
- mol = Volume / 22,4
Hubungan mol, jumlah partikel dan hubungan gas dapat digambarkan dalam bentuk
diagram sebagai berikut :
diagram sebagai berikut :
Sumber: http://bisakimia.com/

Tidak ada komentar:
Posting Komentar