Larutan dapar
Dari Wikipedia bahasa Indonesia, ensiklopedia bebas
- Untuk masing-masing komponen asam atau basa lemah, lihat Zat pendapar.
Larutan dapar (lebih tepatnya, dapar
pH atau dapar
ion hidrogen) adalah
larutan yang mengandung
campuran asam lemah dan
basa konjugatnya, atau sebaliknya. Perubahan pH larutan ini sangat kecil, ketika
asam atau
basa kuat
ditambahkan, dalam jumlah sedikit atau sedang, ke dalam larutan dapar.
Oleh karena itu, larutan ini berguna untuk mencegah perubahan pH
larutan. Larutan dapar digunakan untuk mempertahankan pH pada nilai
tertentu dalam berbagai aplikasi kimia. Kebanyakan bentuk kehidupan
berusaha mempertahankan pH, sehingga mereka menggunakan larutan dapar
untuk menjaga pH konstan. Secara alami,
sistem dapar bikarbonat digunakan untuk mengatur pH
darah.
Prinsip pendaparan (buffering)
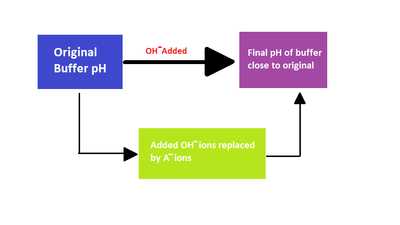
Penambahan ion
hidroksida pada campuran kesetimbangan asam lemah. HA, dan basa konjugatnya, A
-
Larutan dapar dapat mempertahankan pH karena adanya kesetimbangan antara asam HA dan basa konjugatnya A
−.
- HA
 H+ + A−
H+ + A−
Ketika sejumlah
asam kuat ditambahkan ke dalam campuran kesetimbangan asam lemah dan
basa konjugatnya, kesetimbangan bergeser ke kiri, sesuai dengan
prinsip Le Chatelier.
Akibatnya, konsentrasi ion hidrogen meningkat kurang dari yang
seharusnya untuk jumlah asam kuat yang ditambahkan. Sama seperti hal
tersebut, jika basa kuat ditambahkan ke dalam campuran, konsentrasi ion
hidrogen menurun kurang dari yang seharusnya untuk jumlah basa yang
ditambahkan. Efek ini diilustrasikan dengan simulasi titrasi asam lemah
dengan pK
a = 4,7. Konsentrasi relatif asam yang tak
terdisosiasi ditunjukkan sebagai biru dan basa konjugatnya sebagai
merah. Perubahan pH relatif lambat pada rentang dapar, pH = pK
a ± 1, berpusat pada pH = 4,7 di mana [HA] = [A
−].
Konsentrasi ion hidrogen menurun kurang dari seharusnya karena sebagian
besar ion hidroksida yang ditambahkan bereaksi sesuai dengan reaksi
berikut
- OH− + HA → H2O + A−
dan hanya sedikit yang terlibat reaksi netralisasi tersebut yang menghasilkan kenaikan pH.
- OH− + H+ → H2O
Setelah asam 95% terdeprotonasi, pH meningkat tajam karena sebagian
besar basa yang ditambahkan bereaksi dalam reaksi netralisasi.
Kapasitas dapar
Kapasitas dapar, β, adalah pengukuran kuantitatif ketahanan larutan
dapar terhadap perubahan pH pada penambahan ion hidroksida, dan dapat
didefinisikasn sebagai berikut.
![\beta = \frac{dn}{d(p[H^+])}](https://upload.wikimedia.org/math/4/5/b/45b4868896cf89177811f14f264d1d80.png)
dengan dn adalah jumlah tak hingga basa yang ditambahkan dan d(p[H
+]) adalah perubahan tak hingga yang dinyatakan dalam
kologaritma konsentrasi ion hidrogen. Berdasarkan definisi ini, kapasitas dapar asam lemah, dengan tetapan disosiasi K
a, dapat dinyatakan sebagai
![\frac{dn}{d(pH)}=2,303\left(\frac{C_AK_a[H^+]}{\left(K_a+[H^+]\right)^2}\right)](https://upload.wikimedia.org/math/9/5/7/957dca52a9f45005550e200f831a0e14.png)
dengan C
A adalah konsentrasi analitik asam.
[1][2] pH didefinisikan sebagai -log
10[H
+]. Kapasitas dapar senyawa pendapar berada pada nilai maksimum jika p[H
+] = pK
a. Akan jatuh menjadi 33% dari nilai maksimumnya pada p[H
+] = pK
a ± 1 dan menjadi 10% pada p[H
+] = pK
a ± 1.5. Berdasarkan alasan ini, rentang penggunaan berkisar pK
a ± 1. Kapasitas dapar bersifat proporsional terhadap konsentrasi senyawa pendapar, C
A, sehingga larutan encernya memiliki kapasitas dapar rendah.
Air merupakan medium pendapar, meskipun dalam ketiadaan senyawa
pendapar yang ditambahkan. Kapasitas dapar dapat dinyatakan sebagai
![\frac{dn}{d(pH)}=2.303\left([H^+]+[OH^-] \right)](https://upload.wikimedia.org/math/c/6/c/c6cb0bed1b23d96495ba211dc09ec773.png)
- Pada p[H+] yang sangat rendah, konsentrasi ion hidrogen
tinggi dan β meningkat sesuai dengan proporsinya terhadap konsentrasi
ion hidrogen; kapasitas dapar meningkat secara eksponensial terhadap pH.
- Pada p[H+] yang sangat tinggi, konsentrasi ion hidroksida
tinggi dan β meningkat sesuai dengan proporsinya terhadap konsentrasi
ion hidroksida; kapasitas dapar meningkat secara eksponensial terhadap
pH.
Sifat ini tidak bergantung pada keberadaan atau ketiadaan penambahan
senyawa pendapar. Efek dan refleksi konsentrasinya merupakan fakta bahwa
pH terkait dengan logaritma konsentrasi ion hidrogen
Aplikasi
Larutan dapar diperlukan untuk mempertahankan pH untuk
enzim dalam
banyak mikroorganisme agar tetap berfungsi. Kebanyakan enzim hanya
berfungsi pada kondisi yang sangat presisi; jika pH berubah keluar dari
rentang sempitnya, enzim bekerja lambat atau berhenti total dan dapat
mengalami
denaturasi. Dalam banyak kasus, denaturasi dapat melumpuhkan secara permanen aktivitas katalitiknya.
[3] Dapar
asam karbonat (H
2CO
3) dan
bikarbonat (HCO
3−) terdapat dalam
plasma darah, untuk mempertahankan pH antara 7,35 dan 7,45.
Dalam skala industri, larutan dapar digunakan dalam proses
fermentasi dan
untuk mengatur kondisi zat warna yang tepat yang digunakan untuk
mewarnai tekstil. Larutan ini juga digunakan dalam analisis kimia
[2] dan kalibrasi pH meter.
Mayoritas sampel biologi yang digunakan dalam penelitian dibuat dalam dapar, terutama
phosphate buffered saline (PBS) pada pH 7,4.
Senyawa pendapar sederhana
-
| Senyawa pendapar |
pKa |
rentang pH aplikasi |
| Asam sitrat |
3,13; 4,76; 6,40 |
2,1–7,4 |
| Asam asetat |
4,8 |
3,8–5,8 |
| KH2PO4 |
7,2 |
6,2–8,2 |
| CHES |
9,3 |
8,3–10,3 |
| Borat |
9,24 |
8,25–10,25 |
Untuk dapar dalam rentang asam, pH dapat diatur sesuai nilai yang diinginkan dengan menambahkan asam kuat seperti
asam klorida ke dalam zat pendapar. Untuk dapar alkalis, dapat ditambahkan basa kuat seperti
natrium hidroksida.
Alternatif lain, campuran dapar dapat dibuat dari campuran suatu asam
dan basa konjugatnya. Misalnya, dapar asetat dapat dibuat dari campuran
asam asetat dan
natrium asetat. Dengan cara yang sama, dapar alkalis dapat dibuat dari campuran basa dan asam konjugatnya.
Campuran dapar "universal"
Dengan menggabungkan senyawa yang mempunyai perbedaan p
Ka hanya dua atau kurang dan mengatur pH-nya, dapat diperoleh dapar dengan rentang lebar.
Asam sitrat adalah komponen yang berguna pada campuran dapar karena memiliki tiga nilai p
Ka,
yang terpisah dengan perbedaan kurang dari dua. Rentang dapar dapat
diperlebar dengan menambahkan zat pendapar lainnya. Campuran berikut
(larutan
dapar McIlvaine) mempunyai rentang dapar pada pH 3 hingga 8.
[4]
-
| 0,2M Na2HPO4 /mL |
0,1M Asam sitrat /mL |
pH... |
| 20,55 |
79,45 |
3,0 |
| 38,55 |
61,45 |
4,0 |
| 51,50 |
48,50 |
5,0 |
| 63,15 |
36,85 |
6,0 |
| 82,35 |
17,65 |
7,0 |
| 97,25 |
2,75 |
8,0 |
Campuran yang mengandung
asam sitrat,
monokalium fosfat,
asam borat, dan
asam dietil barbiturat dapat dibuat untuk rentang pH 2,6 hingga 12.
[5]
Dapar universal lainnya adalah dapar Carmody
[6] dan
dapar Britton-Robinson, dikembangkan pada tahun 1931.
Senyawa dapar umum dalam biologi
Untuk rentang efektif, lihat
Kapasitas dapar, di atas.
| Nama Umum | Struktur | pKa
pada 25 °C | Pengaruh temperatur
dpH/dT dalam (1/K)[7] | Massa
molekul
|
|---|
Lihat juga dapar biologi:
[8]
Perhitungan pH dapar
Asam monoprotik
Pertama-tama, tuliskan persamaan kesetimbangannya.
- HA
 A− + H+
A− + H+
Ini menunjukkan bahwa ketika asam terdisosiasi akan menghasilkan ion
hidrogen dan anion dengan jumlah setara. Konsentrasi kesetimbangan tiga
komponen ini dapat dihitung dalam
tabel ICE.
-
Tabel ICE untuk asam monoprotik
| R |
[HA] |
[A−] |
[H+] |
| I |
C0 |
0 |
y |
| C |
-x |
x |
x |
| E |
C0-x |
x |
x+y |
Baris pertama, diberi label '
I', menyatakan kondisi awal: konsentrasi asam awal adalah C
0, belum terdisosiasi, sehingga konsentrasi A
− dan H
+ adalah nol; y konsentrasi awal asam kuat yang
ditambahkan,
misalnya asam klorida. Jika yang ditambahkan adalah basa kuat, misal
natrium hidroksida, y akan bernilai negatif karena basa menghilangkan
ion hidrogen dari larutan. Baris kedua, diberi label '
C' untuk perubahan (
Change), menyatakan perubahan yang terjadi ketika asam mengalami disosiasi. Konsentrasi asam menurun sejumlah
-x dan konsentrasi A
− serta H
+ keduanya meningkat sejumlah
+x. Hal ini mengikuti kaidah kesetimbangan. Baris ketiga, diberi label '
E' untuk konsentrasi kesetimbangan (
Equilibrium concentrations), adalah penjumlahan dua baris di atasnya dan menunjukkan konsentrasi pada saat kesetimbangan.
Untuk menentukan
x, gunakan rumus untuk tetapan kesetimbangan yang dinyatakan sebagai konsentrasi:
![K_a = \frac{[H^+] [A^-]}{[HA]}](https://upload.wikimedia.org/math/1/7/9/1797ef4d5bb0d98ca3803b0932e09832.png)
Substitusikan konsentrasi dengan nilai yang diperoleh dari baris terakhir tabel ICE:

Disederhanakan menjadi:

Untuk nilai C
0 tertentu, K
a dan y pada persamaan ini dapat digunakan untuk memecahkan x. Diasumsikan bahwa pH = -log
10[H
+] maka pH dapat dihitung sebagai pH = -log
10(x+y).
Asam poliprotik

% pembentukan spesies terhitung untuk larutan asam sitrat 10 milimolar.
Asam poliprotik adalah asam yang dapat melepaskan lebih dari satu
proton. Tetapan disosiasi proton pertama dapat ditulis sebagai
Ka1 dan tetapan disosiasi proton selanjutnya sebagai
Ka2, dst.
Asam sitrat, H
3A, adalah contoh asam poliprotik yang dapat melepas tiga proton.
-
| kesetimbangan |
nilai pKa |
H3A  H2A− + H+ H2A− + H+ |
pKa1 = 3.13 |
H2A−  HA2− + H+ HA2− + H+ |
pKa2 = 4.76 |
HA2−  A3− + H+ A3− + H+ |
pKa3 = 6.40 |
Jika perbedaan nilai p
K yang berturutan kurang dari tiga, akan
timbul tumpangsuh antara rentang pH spesies dalam kesetimbangan.
Semakin kecil perbedaannya, semakin besar tumpangsuhnya. Dalam kasus
asam sitrat, tumpangsuhnya luas dan larutan asam sitrat dapat mendapar
pada rentang antara pH 2,5 to 7,5.
Perhitungan pH yang melibatkan asam poliprotik memerlukan
perhitungan spesiasi. Dalam kasus asam sitrat, memerlukan pemecahan dua persamaan kesetimbangan massa
![C_A = [A^{3-}]+\beta_1 [A^{3-}][H^+] +\beta_2 [A^{3-}][H^+]^2 +\beta_3 [A^{3-}][H^+]^3](https://upload.wikimedia.org/math/2/5/a/25ab837301737e1c0b28b1283017f424.png)
![C_H = [H^+]+ \beta_1 [A^{3-}][H^+]+ 2\beta_2 [A^{3-}][H^+]^2+ 3\beta_3 [A^{3-}][H^+]^3 -K_w[H^+]^{-1}](https://upload.wikimedia.org/math/9/e/d/9edbeeb82647b032bd23bc299b2dc91a.png)
C
A adalah konsentrasi analitik asam, C
H adalah konsentrasi analitik ion hidrogen yang ditambahkan, β
q adalah
tetapan asosiasi kumulatif.

K
w adalah tetapan ionisasi air. Terdapat dua
persamaan simultan non-linear untuk dua variabel yang tak diketahui [A
3−] dan [H
+].
Banyak program komputer tersedia untuk melakukan perhitungan ini.
Diagram spesiasi asam sitrat juga dapat dihasilkan oleh program HySS.
[9]
Referensi
- ^ Butler, J.N. (1964). Ionic Equilibrium: A Mathematical Approach. Addison-Wesley. p. 151.
- ^ a b Hulanicki, A. (1987). Reactions of acids and bases in analytical chemistry. Horwood. ISBN 0-85312-330-6. (translation editor: Mary R. Masson)
- ^ Scorpio, R. (2000). Fundamentals of Acids, Bases, Buffers & Their Application to Biochemical Systems. ISBN 0-7872-7374-0.
- ^ McIlvaine, T.C. (1921). "A buffer solution for colorimetric comparaison" (PDF). J. Biol. Chem. 49 (1): 183–186.
- ^ Mendham, J.; Denny, R.C.; Barnes, J.D.; Thomas, M (2000). Vogel's textbook of quantitative chemical analysis (5th. ed.). Harlow: Pearson Education. ISBN 0-582-22628-7. Appendix 5
- ^ Carmody, Walter R. (1961). "Easily prepared wide range buffer series". J. Chem. Educ. 38 (11): 559–560. Bibcode:1961JChEd..38..559C. doi:10.1021/ed038p559.
- ^ "Buffer Reference Center". Sigma-Aldrich. Diakses tanggal 2009-04-17.
- ^ "Biological buffers". REACH Devices.
- ^ Alderighi, L.; Gans, P.; Ienco, A.; Peters, D.; Sabatini, A.; Vacca, A. (1999). "Hyperquad
simulation and speciation (HySS): a utility program for the
investigation of equilibria involving soluble and partially soluble
species". Coordination Chemistry Reviews 184 (1): 311–318. doi:10.1016/S0010-8545(98)00260-4.
- https://id.wikipedia.org/wiki/Larutan_dapar
 H+ + A−
H+ + A−









 A− + H+
A− + H+ H2A− + H+
H2A− + H+ HA2− + H+
HA2− + H+ A3− + H+
A3− + H+
![\beta = \frac{dn}{d(p[H^+])}](https://upload.wikimedia.org/math/4/5/b/45b4868896cf89177811f14f264d1d80.png)
![\frac{dn}{d(pH)}=2,303\left(\frac{C_AK_a[H^+]}{\left(K_a+[H^+]\right)^2}\right)](https://upload.wikimedia.org/math/9/5/7/957dca52a9f45005550e200f831a0e14.png)
![\frac{dn}{d(pH)}=2.303\left([H^+]+[OH^-] \right)](https://upload.wikimedia.org/math/c/6/c/c6cb0bed1b23d96495ba211dc09ec773.png)
![K_a = \frac{[H^+] [A^-]}{[HA]}](https://upload.wikimedia.org/math/1/7/9/1797ef4d5bb0d98ca3803b0932e09832.png)



![C_A = [A^{3-}]+\beta_1 [A^{3-}][H^+] +\beta_2 [A^{3-}][H^+]^2 +\beta_3 [A^{3-}][H^+]^3](https://upload.wikimedia.org/math/2/5/a/25ab837301737e1c0b28b1283017f424.png)
![C_H = [H^+]+ \beta_1 [A^{3-}][H^+]+ 2\beta_2 [A^{3-}][H^+]^2+ 3\beta_3 [A^{3-}][H^+]^3 -K_w[H^+]^{-1}](https://upload.wikimedia.org/math/9/e/d/9edbeeb82647b032bd23bc299b2dc91a.png)

Tidak ada komentar:
Posting Komentar